di Angelo Miceli & Carmelo Di Vincenzo
Comunemente conosciuto, su tutto il territorio nazionale, con la denominazione volgare di “Steccherino dorato”, con la quale si è soliti fare riferimento anche ad altre specie fungine appartenenti allo stesso genere, Hydnum repandum, specie polimorfa per la variabilità della forma, delle dimensioni e del colore [Papetti et al., 2004] a crescita ubiquitaria, indifferentemente nei boschi di latifoglie, aghifoglie o misti, risulta essere facilmente riconoscibile soprattutto per la particolare conformazione dell’imenoforo che evidenzia numerosi piccoli aculei molto serrati e per diversi altri particolari cui faremo riferimento nel corso della nostra “Riflessione Micologica”.
Genere Hydnum L. nom. sanct.
Sp. pl. 2: 1178 (1753)
Autore sanzionante: Fries, Syst. mycol. 1: 397 (1821)
Specie tipo
Hydnum repandum L. nom. sanct.
Sp. pl. 2: 1178 (1753)
Etimologia:
Hydnum dal greco ὔδνον (hýdnon) = tubero. Si ritiene che il nome sia stato attribuito arbitrariamente da Linneo senza alcun riferimento alle caratteristiche di questo genere di funghi [Acta Plantarum, 2022];
Al genere appartengono sporofori omogenei, di piccole, medie o grandi dimensioni a crescita terricola, ectomicorrizici, provvisti di cappello e gambo caratterizzati da imenoforo ad aculei detti idni che, a seconda della specie di appartenenza, si presentano con andamento più o meno decorrente sul gambo [Buda, 2011]. Vengono inseriti, per la particolare conformazione dell’imenoforo, nel gruppo informale dei “funghi idnoidi”, chiaramente polifiletico in quanto la specifica conformazione imeniale, caratterizzata dalla presenza di aculei, si è sviluppata in diverse famiglie di funghi, inserite nello stesso gruppo informale, che non risultano filogeneticamente correlate tra di loro quali, ad esempio:Thelephoraceae, Hericiaceae. Hydnaceae…. [Boccardo et al., 2008].
L’originario inserimento del genere nell’ordine Cantharellales Gäum., effettuato in origine sulla base della similarità di alcuni elementi microscopici, quali, ad esempio, gli “sticobasidi”,(1) con quelli di altri generi inseriti nello stesso ordine, è stato recentemente confermato da approfonditi studi di natura filogenetico-molecolare condotti da diversi studiosi in varie parti del mondo [Vizzini et al., 2013].
Le varie specie appartenenti al genere sono ritenute commestibili e trovano ampia diffusione territoriale su diverse aree geografiche a clima temperato, quali, ad esempio, Europa, Nord America, Asia, Australia e Nuova Zelanda [Olariaga et al., 2012].
Recenti studi di natura filogenetico-molecolare [Niskanen et al., 2018], hanno fornito elementi utili alla descrizione di nuove specie fungine e di suddividere il genere in quattro sottogeneri, tra i quali è stato mantenuto l’originario sottogenere Hydnum:
- Hydnum sottogenere Alba Niskanen & Liimat., subgen. nov.
Index Fungorum: IF553874 (2018)
- Hydnum sottogenere Pallida Niskanen & Liimat., subgen. nov.
Index Fungorum: IF553879 (2018)
- Hydnum sottogenere Hydnum L.
Sp. pl. 2: 1178 (1753)
Il sottogenere comprende due sezioni: Hydnum e Olympica.
- Hydnum sottogenere Rufescentia Niskanen & Liimat., subgen. nov.
Index Fungorum: IF553889 (2018)
Il sottogenere comprende due sezioni: Rufescentia e Magnororufescentia.
Nei sottogeneri sopra indicati sono state inserite numerose specie quasi tutte istituite, ex novo, nell’anno 2018 [Niskanen], a seguito ritrovamenti effettuati in aree geografiche europee ed extraeuropee, difficilmente determinabili al solo esame macroscopico, rendendosi necessaria, per una corretta determinazione, l’indagine microscopica.
Per ulteriori approfondimenti si rimanda il lettore all’articolo di riferimento sopra citato e meglio specificato in bibliografia.
Le varie specie appartenenti al genere sono caratterizzate da:
cappello di piccole, medie o grandi dimensioni, può raggiungere, secondo quanto riportato in letteratura, anche 20 cm di diametro [Niskanen et al., 2018], irregolare, ondulato, superficie liscia o appena tomentosa (ricoperta da finissima e fitta peluria), colore variabile da biancastro ad arancione, bruno aranciato [Niskanen et al., 2018]; bordo ottuso, leggermente arrotondato.
Imenoforo ad aculei più o meno decorrenti o adnati al gambo.
Gambo irregolare, a volte eccentrico, da biancastro a giallo tenue fino a bruno pallido. Carnecompatta, spessa, fragile, cassante.
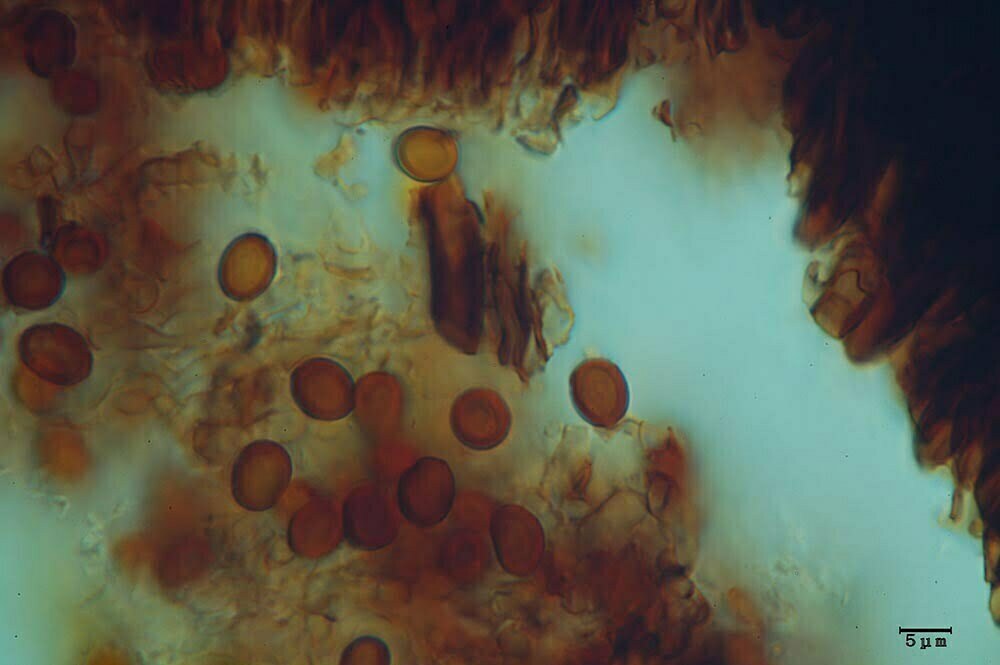
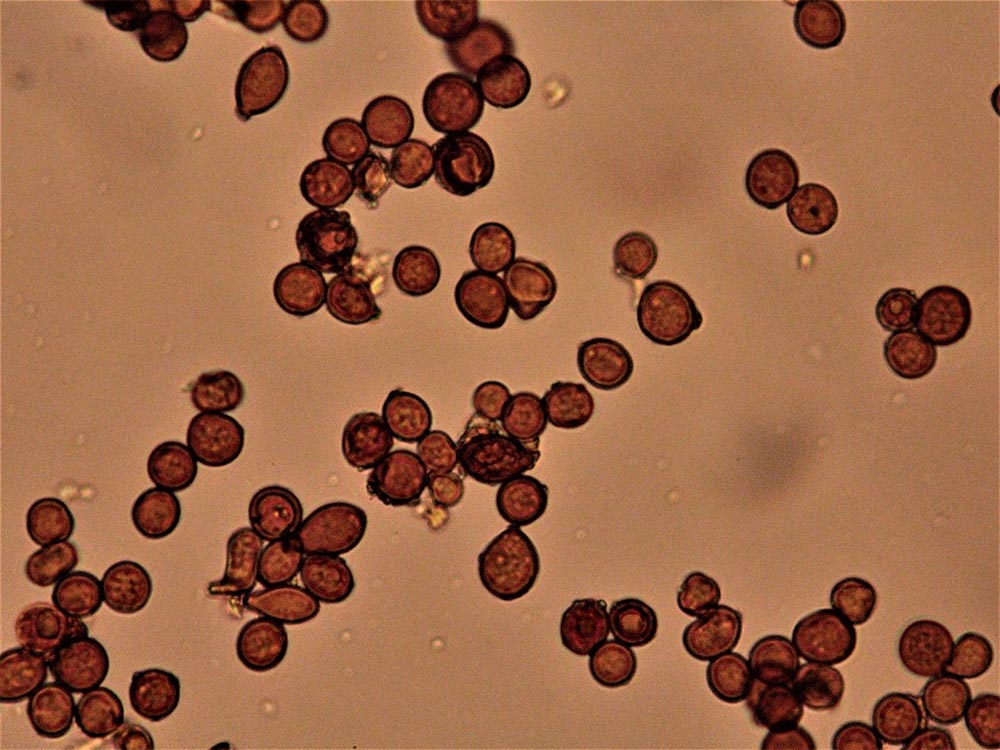
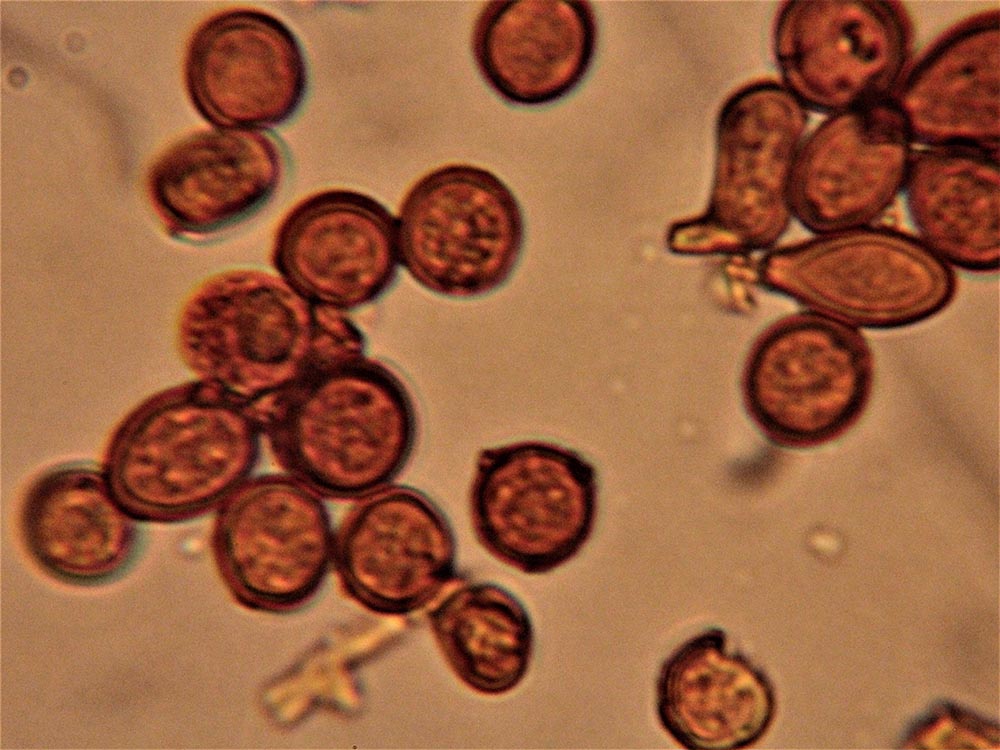
Spore da subglobose a ellittiche, lisce, non amiloidi, prive di poro germinativo. Sporata bianco-crema [Della Maggiore & Pera, 2021].
Hydnum repandum L. nom. Sanct.
Autore sanzionante: Fries, Syst. mycol. 1: 400 (1821)
Accentazione: Hýdnum repándum
Etimologia: repandum dal latino repàndus = riavvolto in alto, per la particolare conformazione del margine del cappello [Buda, 2011; Acta Plantarum, 2022].
Posizione sistematica: divisione Basidiomycota R.T. Moore, classe Agaricomycetes Doweld, ordine Cantharellales Gäum., famiglia Hydnaceae Chevall., genere Hydnum [IF, 2022; MB, 2022]; sottogenere Hydnum L., sezione Hydnum L. [Niskanen et al., 2018].
Principali sinonimi
≡ Hypothele repanda (L.) Paulet, Icon. Champ. (Paris): tab. 35:1-2 (1812)
≡ Dentinum repandum (L.) Gray, Nat. Arr. Brit. Pl. (London) 1: 650 (1821)
≡ Tyrodon repandus (L.) P. Karst., Revue mycol., Toulouse 3(no. 9): 19 (1881)
≡ Sarcodon repandus (L.) Quél., Enchir. fung. (Paris): 189 (1886)
= Hydnum flavidum Schaeff., Fung. bavar. palat. nasc. (Ratisbonae) 4: 99 (1774)
= Hydnum rufescens Schaeff., Fung. bavar. palat. nasc. (Ratisbonae) 4: 95 (1774)
≡ Sarcodon rufescens (Schaeff.) Quél., Fl. mycol. France (Paris): 447 (1888)
= Hydnum clandestinum Batsch, Elench. fung. (Halle): 113 (1783)
= Hydnum medium Pers., Observ. mycol. (Lipsiae) 2: 97 (1800)
Nomi volgari: Gallinaccio spinoso, Steccherino [Bonazzi, 2003]. Steccherino dorato [Bonazzi, 2003; Buda, 2011]; “Wood Urchins” (riccio di bosco), denominazione in uso nei paesi anglosassoni e riferita a tutte le specie appartenenti al genere [Olariaga et al., 2012].
Nomi dialettali: Funciu musca (nome dialettale siciliano [Bonazzi, 2003; Buda, 2011].
Descrizione macroscopica
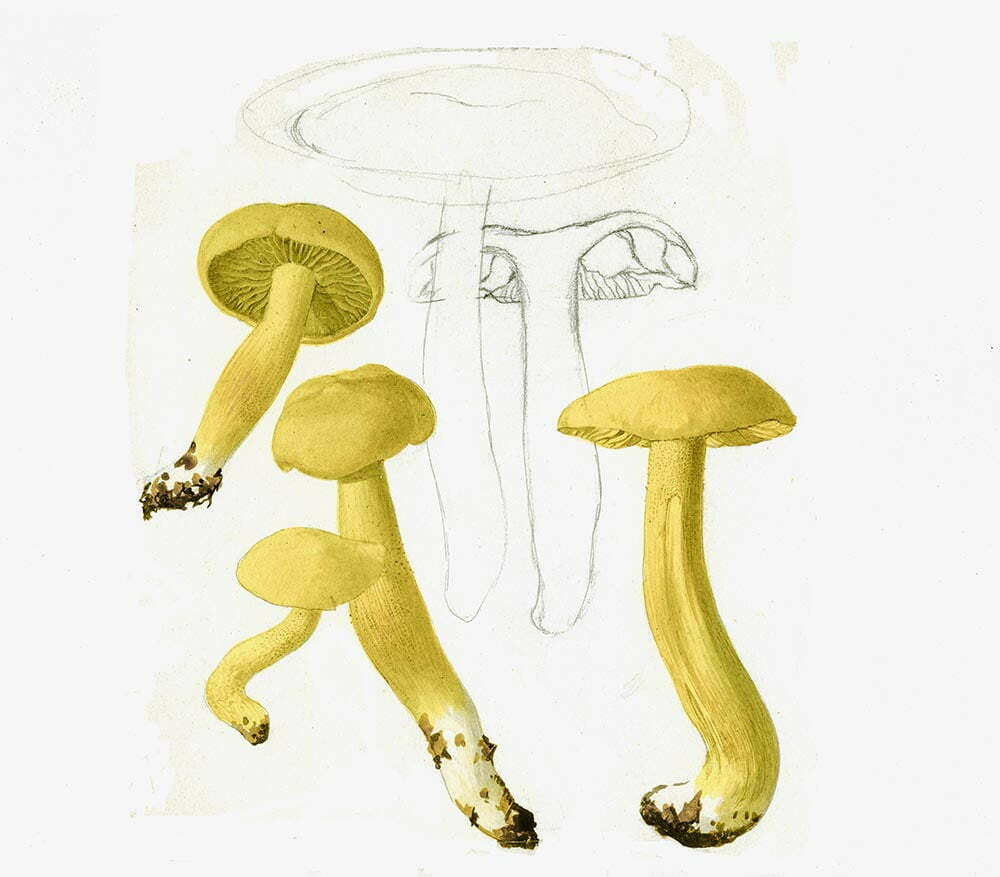
Cappello di medio-grandi dimensioni, può superare, a volte, i 15 cm [Della Maggiora & Pera, 2021], carnoso, gibboso, con andamento irregolare, inizialmente convesso, poi, verso la maturazione, depresso, superficie liscia, asciutta, finemente vellutata, inizialmente di colore biancastro, giallognolo, giallo-aranciato; margine involuto, poi disteso, sinuoso, lobato. Imenoforo costituito da numerosi aculei (idni) molto fitti, fragili, facilmente asportabili, leggermente decorrenti sul gambo, inizialmente di colore giallognolo, tendenti, verso la maturazione, ad assumere tonalità ocracee. Gambo cilindrico, pieno, robusto, ingrossato alla base, eccentrico o anche laterale, bianco-giallastro, ingiallente alla manipolazione. Spore in massa biancastre. Carne consistente, spessa, soda, cassante (quando alla frattura produce un leggero rumore, come di gesso spezzato [Mazza, 2012], bianca con toni aranciati, ingiallente all’aria. Odore mite, leggero, gradevole; sapore gradevole, a volte amarognolo.




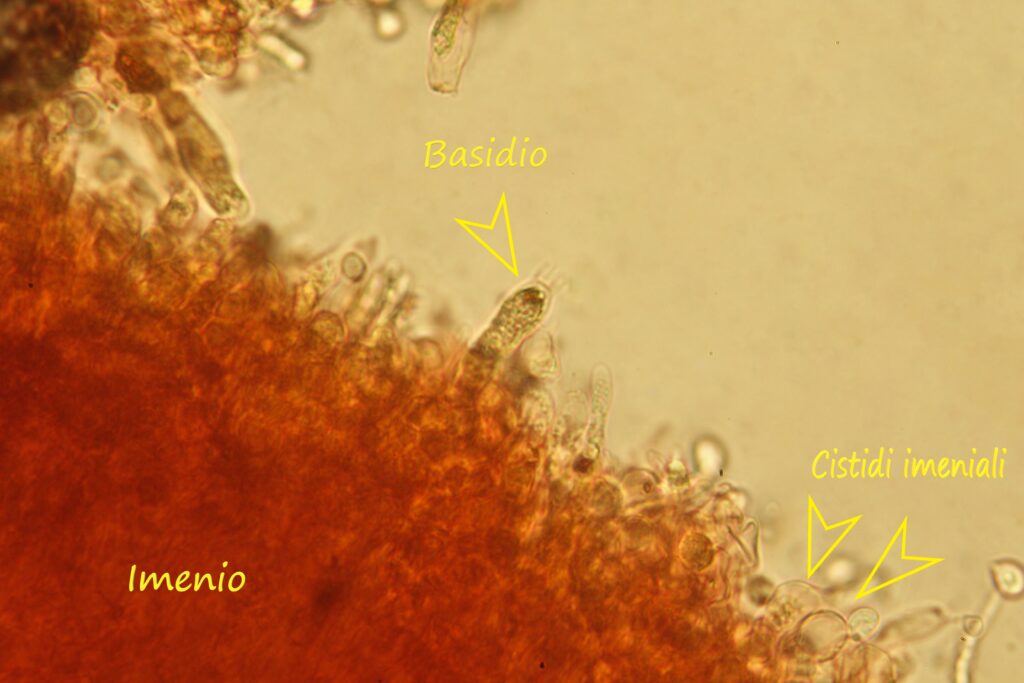
Descrizione microscopica
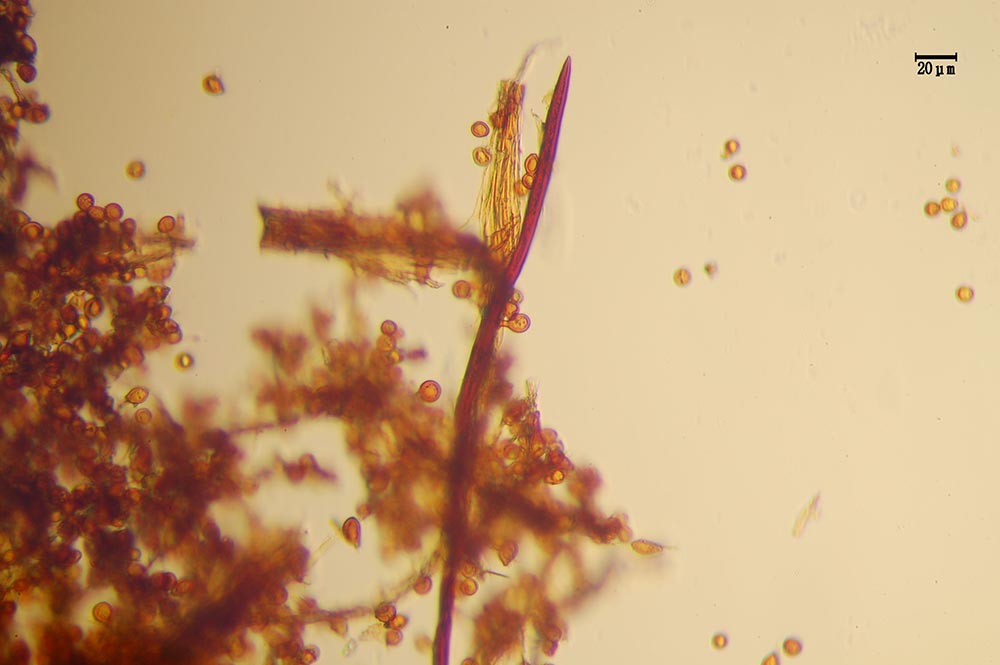
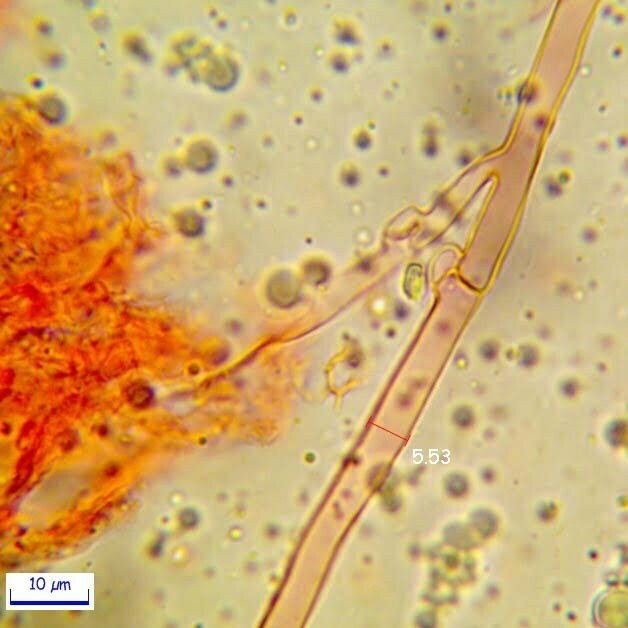
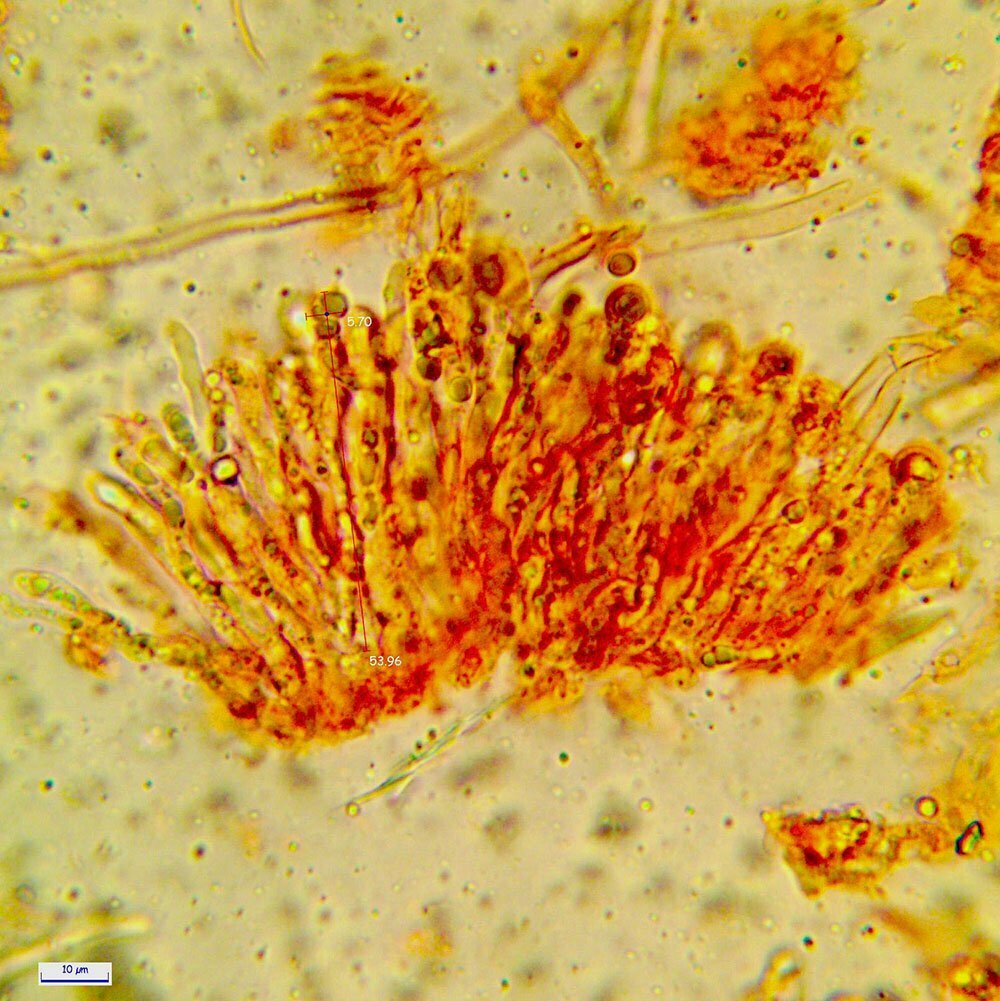
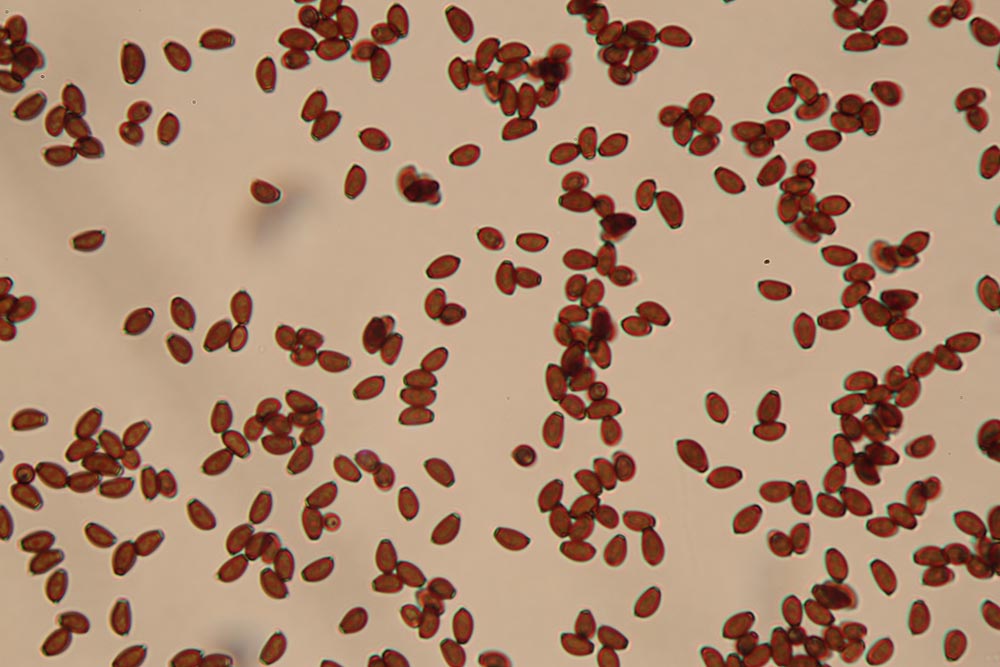
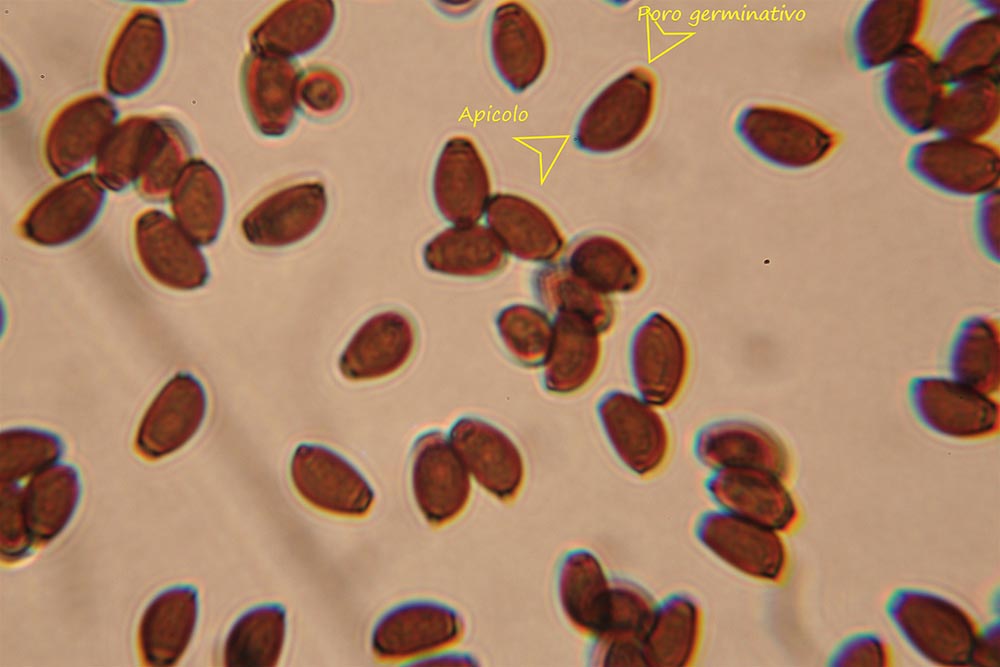
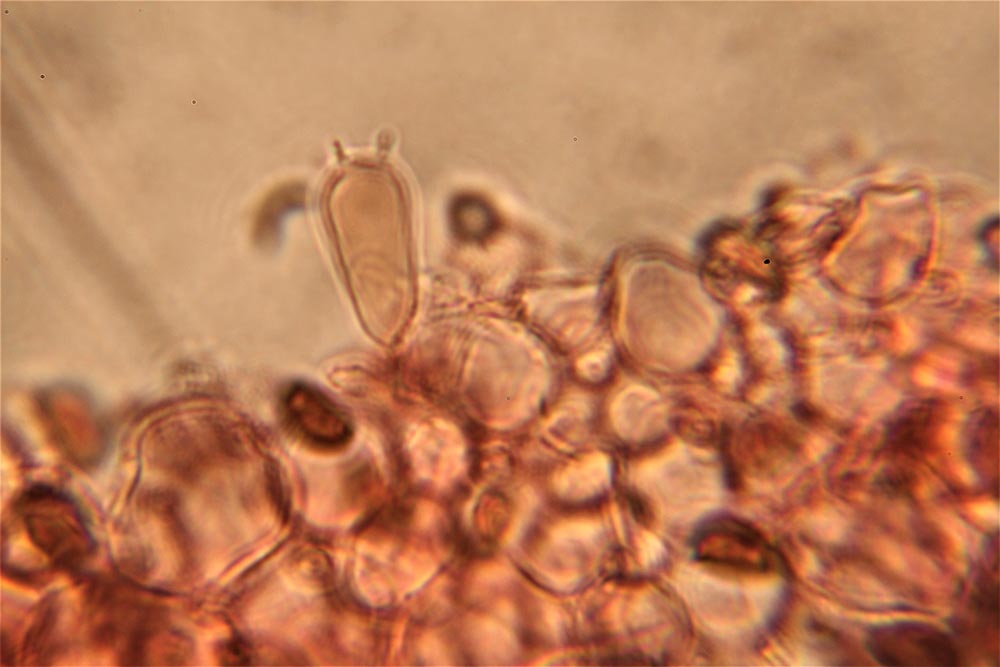
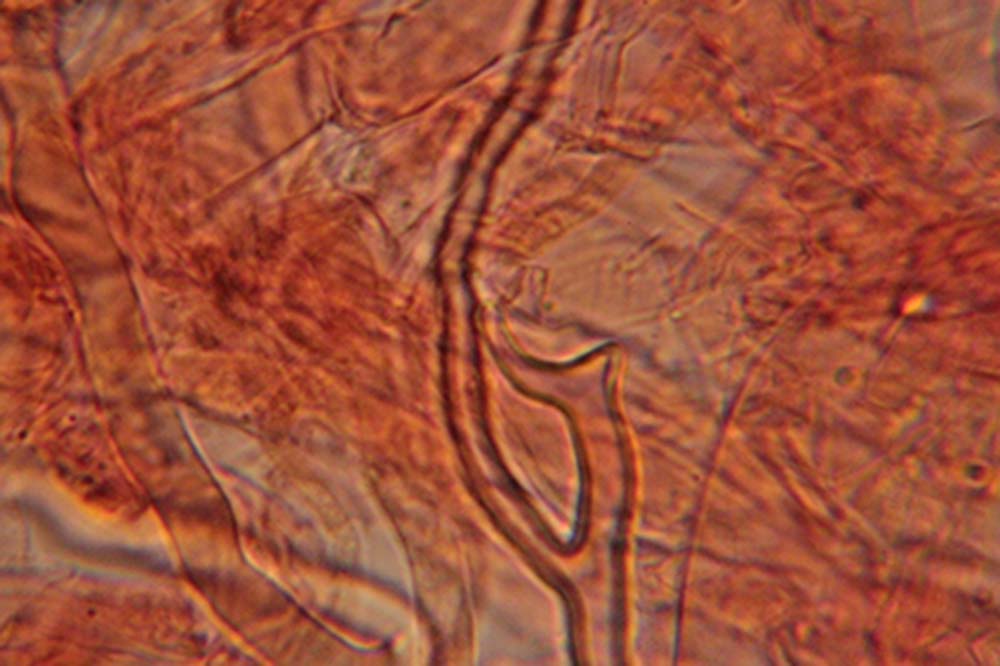
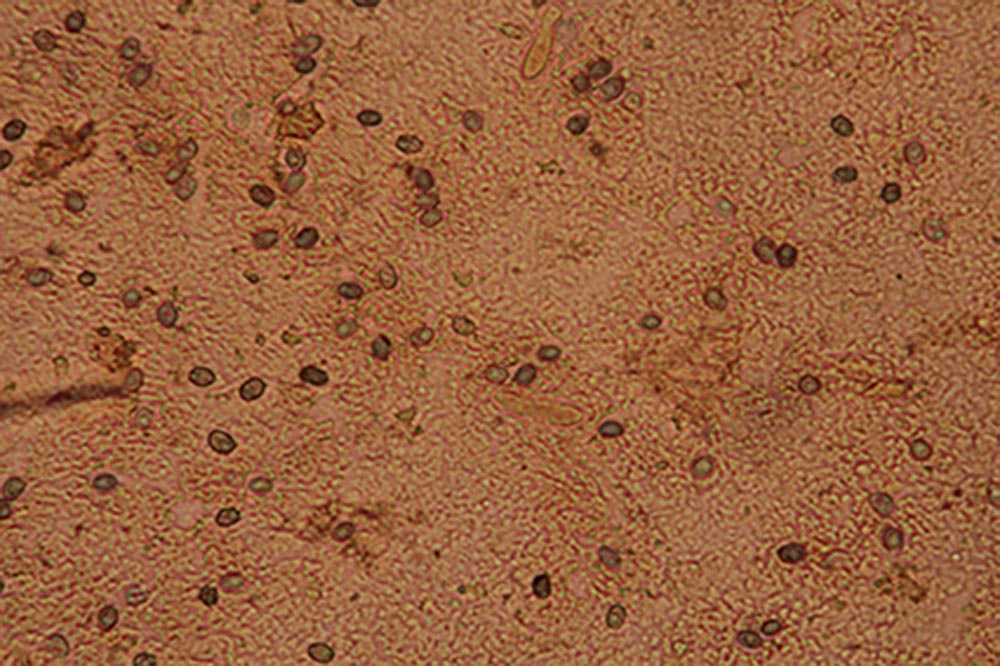
Spore (7.2) 7.4-8.6 (9.1) x (5.5) 5.6-6.7 (6.9) μm; Q = (1.2) 1.22-1.48 (1.5); V = (118) 135-196 (214) μm3, ellissoidali lisce, con apicolo evidente. Basidi 31,57 x 8,9 μm, tetrasporici, leggermente clavati. Giunti a fibbia presenti. Cistidi imeniali presenti.


Habitat
Specie molto comune, cresce, tipicamente, dall’autunno al periodo invernale, indifferentemente nei boschi di latifoglie, aghifoglie o misti spesso in gruppi molto numerosi anche con esemplari cespitosi.
Commestibilità: commestibile da giovane, preferibilmente privo degli aculei. Gli esemplari maturi sono amarognoli e poco digeribili. Gli esemplari giovani si prestano bene alla conservazione sott’olio [Bertinaria et al., 2020].
Caratteri differenziali
Prima dei recenti studi di natura filogenetico-molecolare che hanno consentito di creare nuove specie, H. repandum risultava facilmente riconoscibile e diversificabile dalle specie appartenenti allo stesso genere per l’imenoforo ad aculei decorrenti sul gambo. Oggi, considerato che sono state create nuove specie con caratteristiche morfologiche perfettamente identiche, per una corretta determinazione si deve ricorrere, necessariamente, all’esame dei caratteri microscopici. In ogni caso, ai soli fini orientativi, ci piace indicare le seguenti
Specie simili
- Hydnum rufescens Pers.
Observ. mycol. (Lipsiae) 2: 95 (1800)

Specie molto simile e facilmente confondibile, differisce per le dimensioni leggermente inferiori; per il portamento esile; per le colorazioni più vivaci e più sature; per gli aculei adnati sul gambo, mai decorrenti.
- Hydnum albidum Peck, Bull.
N.Y. St. Mus. nat. Hist. 1(no. 2): 10 (1887)
Per la particolare colorazione, inizialmente bianco-grigiastra, poi bianco-avorio, dei carpofori, può essere facilmente scambiato con esemplari di H. repandum di colorazione biancastra, differisce per le dimensioni minori; per gli aculei poco o non decorrenti; per l’ingiallimento delle superfici alla manipolazione; per le spore di dimensioni minori.
- Cantharellus cibarius Fr.
Syst. mycol. (Lundae) 1: 318 (1821)

Anche se strutturalmente molto diverso, per la similarità delle colorazioni viene spesso e facilmente confuso dai raccoglitori principianti che, nella fretta della raccolta, non osservano le principali caratteristiche differenziali quali, ad esempio, l’imenoforo costituito da pseudolamelle (pliche lamellari).
Indichiamo ancora, tra le specie di nuova creazione, differenziabili esclusivamente dalla conformazione delle spore, ma non solo:
- Hydnum ellipsosporum Ostrow & Beenken sp. nov.
Z. Mykol. 70(2): 139 (2004)
Differenziabile, attraverso esame microscopico, per la forma ellissoidale delle spore. Indicazione a titolo orientativo e non sufficiente, da sola, per una corretta determinazione.
- Hydnum ovoideisporum Olariaga, Grebenc, Salcedo & M.P. Martín sp. nov.
Mycologia 104(6): 1446 (2012)
Differenziabile, attraverso esame microscopico, per la forma delle spore da ovoidale a largamente ellissoidale o, a volte, cilindrica [Olariaga et al., 2012]. Indicazione a titolo orientativo e non sufficiente, da sola, per una corretta determinazione.
- Hydnum ovoideisporum f. depauperatum Picillo, Vizzini & Contu, f. nov. Mycosphere 4(1): 37 (2013)
Particolare e rara specie che, nonostante il genere di appartenenza, differisce da tutte le altre specie congeneri per la conformazione dell’imenio che si presenta completamente liscio, ovvero totalmente privo degli aculei [Vizzini et al., 2013]. In particolare, differisce da H. repandum per la conformazione globosa delle spore.
In conclusione, ribadiamo il concetto, consigliamo a quanti volessero approfondire lo studio del genere Hydnum e conoscere l’evoluzione degli studi di natura filogenetico-molecolare che recentemente hanno dato una nuova conformazione tassonomica e sistematica alle varie specie inserite nel genere, di consultare i seguenti riferimenti bibliografici: Olariaga et al, 2012; Vizzini et al., 2013; Niskanen et al., 2018.
**************
- Sticobasidio: “basidio cilindraceo i cui fusi nucleari si trovano in posizione longitudinale e a diverse altezze; con lo sviluppo, esso si allunga progressivamente, emergendo infine dallo strato imeniale [Mazza, 2012].
***************
Bibliografia
- Bertinaria Giorgio, Tizzoni Renato, Zorio Piero, 2020: Atlante dei funghi del Biellese. E20ProgettiEditore, Biella. I
- Boccardo Fabrizio, Traverso Mido, Vizzini Alfredo, Zotti Mirca, 2008: Funghi d’Italia. Ristampa 2013. Edit. Zanichelli, Bologna. I
- Bonazzi Ulderico, 2003: Dizionario dei nomi volgari e dialettali dei funghi in Italia e nel Canton Ticino. A.M.B. Fondazione Centro Studi Micologici, Trento. I
- Buda Andrea, 2011: I Funghi degli Iblei. Vol. 1. A.M.B. Gruppo di Siracusa. Siracusa. I
- Della Maggiora Marco, Pera Umberto, 2021: Funghi in Toscana. AGMT (Associazione Gruppi Micologici Toscani). La Pieve Poligrafica, Villa Verrucchio (RN). I
- Mazza Riccardo, 2012: Dizionario illustrato dei funghi – Mykonolexikon 2. Romar Srl, Segrate (MI). I
- Niskanen Tuula, Liimatainen Kare, Nuytinck Jorinde, Kirk Paul, Ibarguren Ibai Olariaga, Garibay-Orijel Roberto, Norvell Lorelei, Huhtinen Seppo, Kytövuori Ilkka, Ruotsalainen Juhani, Niemelä Tuomo, Ammirati Joseph F., Tedersoo Leho, 2018: Identifying and naming the currently known diversity of the genus Hydnum, with an emphasis on European and North American taxa. Mycologia, Vol. 110 (5): 890-918.
- Olariaga Ibai, Grebenc Tine, Salcedo Isabel, Martin Maria P., 2012: Two new species of Hydnum with ovoid basidiospores: H. ovoideisporum and H. vesterholtii. Mycologia, Vol. 104 (6): 1443-1455
- Papetti Carlo, Consiglio Giovanni, Simonini Giampaolo, 2004: Atlante fotografico dei Funghi d’Italia, Vol. 1 (seconda ristampa). A.M.B. Fondazione Centro Studi Micologici, Trento. I
- Vizzini Alfredo, Picillo Bernardo, Ercole Enrico, Voyron Samuele, Contu Marco, 2013: Detecting the variability of Hydnum ovoideisporum (Agaricomycetes, Cantharellales) on the basis of Italian collections, and H. magnorufescens sp. nov. Mycosphere 4:32-44
Sitografia
- Acta Plantarum (ultima consultazione dicembre 2022): Etimologia dei nomi botanici e micologici e corretta accentazione.
- IF (ultima consultazione, dicembre 2022), Indexfungorum database.
- MB (ultima consultazione, dicembre 2022), Mycobank database. Fungal databases, Nomenclature e Special Banks.